Secuencia 25:
La constitución de la materia.
Aprendizaje esperado:
Explora algunos avances recientes en la constitución de la materia y reconoce el proceso histórico de construcción de nuevas teorías.
TEORÍA ATÓMICA
(Desarrollo del modelo estándar)
(Desarrollo del modelo estándar)
Observa el siguiente video:
Lee los puntos más relevantes de la teoría atómica:
Los griegos Demócrito y Leucipo (siglo V a.C.), manejaron la idea de materia discontinua y que estaba formada por pequeñas partículas a las que llamaron átomo que en griego significa "indivisible" o "sin división".


El filósofo griego Aristóteles rechazó la idea del átomo, manejó la idea de materia continua y promovió la teoría de los cuatro elementos.

1808, el inglés John Dalton enunció cuatro postulados:

El filósofo griego Aristóteles rechazó la idea del átomo, manejó la idea de materia continua y promovió la teoría de los cuatro elementos.

- La materia está formada por átomos y éstos son indestructibles.
- Los átomos de un mismo elemento son iguales entre sí.
- Los átomos de diferentes elementos son también diferentes.
- Los átomos se combinan entre sí para formar compuestos.


1887, el inglés Joseph John Thomson, mediante un experimento descubre las cargas negativas (electrones) y elabora el primer modelo atómico conocido como "budín de pasas".




El alemán Eugen Goldstein en 1886, descubre las cargas positivas (protones) y establece que el átomo es eléctricamente neutro por tener el mismo número de cargas negativas y positivas.

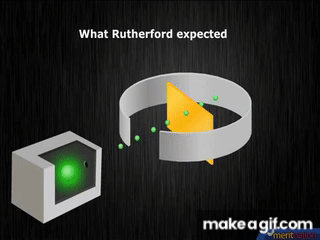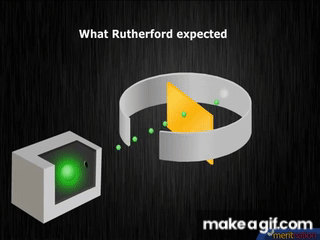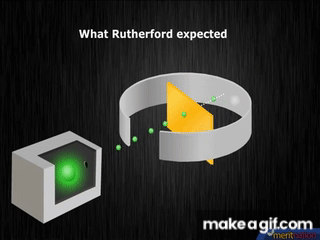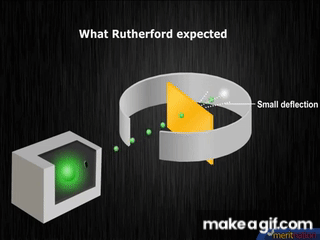




1909, el neozelandés Ernest Rutherford, descubre el núcleo atómico, elabora un modelo con electrones girando en órbitas alrededor del núcleo; lo compara con un sistema planetario en miniatura.




El Danés Niels Bohr, en 1913, propone un modelo atómico basado en la teoría cuántica de Max Planck y establece los siguientes postulados:
- Un átomo tiene un núcleo en donde se encuentra casi la totalidad de su masa (protones +) y neutrones(+ -).
- Los electrones (-) giran alrededor del núcleo en órbitas fijas.
- Las órbitas se conocen como niveles de energía.
- Las órbitas cercanas al núcleo son de baja energía y las lejanas al núcleo son de alta energía.
- Los electrones pueden cambiar de una órbita a otra liberando o absorbiendo energía.
- La energía que gana o pierde un electrón se denomina "cuanto de energía".
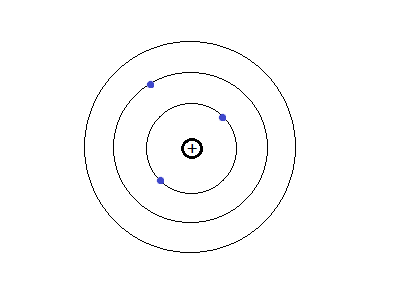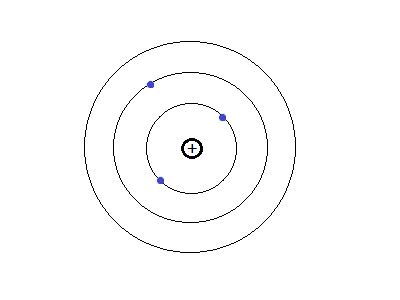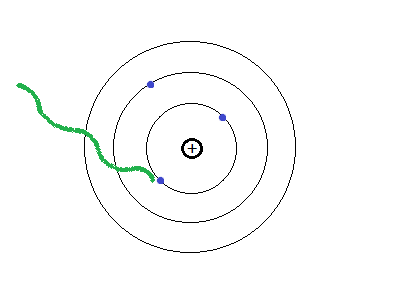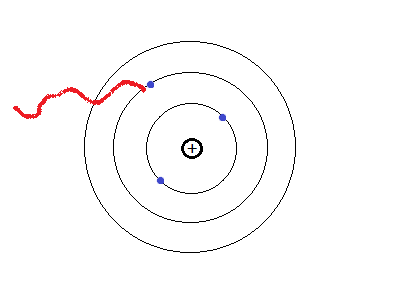
Pero, ¿cómo se mueve el electrón?

MOVIMIENTO DEL ELECTRÓN
Cuando dos cuerpos con carga eléctrica se acercan o se juntan, ocurren las siguientes fuerzas electrostáticas:
 |
| Fuerzas electrostáticas |
Como puedes observar en la imagen, los cuerpos con cargas iguales se rechazan (repulsión electrostática), mientras que los cuerpos con cargas contrarias se atraen (atracción electrostática).
El electrón, al girar sobre su órbita, tiene fuerza centrífuga, sin embargo como es negativo, recibe una fuerza de atracción electrostática por parte de los protones positivos del núcleo.
Al estar sometido a la acción de dos fuerzas (centrífuga y atracción electrostática), se mueve en dirección hacia la resultante.
Como puedes observar, el movimiento del electrón es similar al de los planetas alrededor del Sol o al de la Luna alrededor de la Tierra.
Elaborar ficha de trabajo No. 25
- Escribe el título de la secuencia y copia el aprendizaje esperado.
- Teniendo en cuenta la línea del tiempo, elabora un mapa conceptual con los científicos más relevantes que participaron en la construcción del modelo atómico y sus principales aportaciones.
- Dibuja el modelo atómico de Bohr, señalando la ubicación de las partículas subatómicas (electrones, protones y neutrones).
- Copia el dibujo de las fuerzas electrostáticas y, en forma concreta, explica que fuerza se presenta en cada uno de los casos.
- Con ayuda de imágenes, realiza el apunte que consideres pertinente.




